標簽:
聽說,藥品專利要被強制許可了
喧嚷的醫藥改革文件出臺后,提高仿制藥審評標準、生物等效性試驗實施備案制、新藥定義的調整等新規定都引起了業內的積極討論和思考。因為這是一個里程碑式的改革,意味著新藥將成為如假包換的新藥,仿制藥也逐漸走上了質量讓老百姓放心、簡化申請讓企業安心的正軌。
然而,就在這時候,國家衛生計生委疾病預防控制局發布了《關于印發中國癌癥防治三年行動計劃(2015-2017 年)的通知》,其中一項計劃是這樣的:
探索通過利用專利實施強制許可制度提高藥物可及性的可行性,國內尚不能仿制的,通過建立談判機制,降低采購價格,加快國內相關藥品上市速度。
什么意思呢?如果國內企業想要仿制抗腫瘤藥但遇到了專利問題,沒有關系,不需要專利挑戰也不需要擔心侵權,國家會努力以「專利實施強制許可」這把鏟子來鋪平抗腫瘤仿制藥的道路。
于是,藥品專利實施強制許可的傳說有可能就這樣被「照進」現實。這是對仿制藥企業和腫瘤患者的利好,還是變相的市場保護?
什么是專利實施強制許可?
專利實施強制許可,指在未經專利所有權人同意的情況下,一國政府允許第三方生產專利產品或使用專利過程。
這項制度的淵源可追溯到 1884 年的《保護工業產權巴黎公約》,隨后,《與貿易有關的知識產權協議(TRIPS)》(1993 年)和《TRIPS 協定與公眾健康宣言(多哈宣言)》(2001 年)中明確了該項制度,規定「授予權利的例外」和「未經權利人授權的其他使用」條款及其嚴格限制條件,同時給予 WTO 各成員國為了公共健康而靈活使用這項條款的權利。
印度等國雖有先例,但大多數國家并未真正實施
雖然這是一項 WTO 各成員國為了公共健康可靈活行使的權利,但也有著嚴格的限制條件。《多哈宣言》的 5(c)條款描述了「公共健康」的范圍:
各成員國有權決定構成國家緊急狀況或其它緊急情況的條件,可以理解公共健康危機,包括與艾滋病、結核病、瘧疾以及其他傳染病有關的危機,構成上述國家緊急狀況或其它緊急情況。
那么,為了公共健康,實施過專利強制許可的國家有哪些?
國際上,南非、馬來西亞、印尼等國家曾實施過藥品專利強制許可,大多是針對傳染性疾病藥品,如艾滋病、結核病等疾病的二線藥物、固定劑量復方制劑和兒童制劑的仿制藥。
其中,2006 -2008 年,泰國政府批準了多個藥品專利實施強制許可,包括心血管藥物波立維以及弗隆、塔西法和泰索帝 3 個抗腫瘤藥物。
2013 年,印度也開了本國藥品專利實施強制許可的先河:基于專利藥未滿足公眾需求、價格不合理和未在印度領土范圍內使用(僅在印度 4 個城市可以購買)三個理由,印度政府允許 Natco 公司仿制生產拜耳治療腎癌和肝癌藥物 Nexavar(多吉美,甲苯磺酸索拉非尼),以此換來了該藥價格 97% 的下降幅度。
再來看看美國、加拿大、歐洲、巴西等國家,雖然在立法中都不同程度地認可強制許可,但無論是針對抗艾滋病藥物、炭疽病毒藥物還是人類免疫干擾素,并未真正實施,而是將強制許可作為降低專利藥價格的談判手段 。
中國在《專利法》和《專利實施強制許可辦法》中同樣認可藥品專利強制許可制度,且條件限制為「緊急狀態下的公共利益」或「為了公共健康」。但是,就算在 2005 年禽流感大面積爆發時,中國也并未同意廣州白云山的強制許可請求,而是以羅氏妥協將生產許可授權給了上海醫藥集團和廣東東陽光集團收場。
由此我們知道,印度等國雖有抗腫瘤藥專利實施強制許可的先例,但大多數國家就連艾滋病藥物、人類免疫干擾素等藥品都未真正實施強制許可。
中國哪些藥品可能會成為下一個印度的 Nexavar ?
眾所周知,印度允許強制許可 Nexavar 并非印度首次通過具有印度特色的專利法律制度使仿制藥企業獲益,諾華格列衛(甲磺酸伊馬替尼)專利申請被駁回至今還被媒體津津樂道。
而此次中國衛計委宣布要「探索通過利用專利實施強制許可制度提高藥物可及性的可行性」,頗有人家印度都實施了,我們為了「藥品可及性」也要強制許可抗腫瘤藥專利的意味。
難道中國是想成為下一個印度嗎?
根據 Insight 數據庫,中國已經獲批進口且國內尚無仿制藥上市的抗腫瘤藥共有 25 個(按成分詞計),目前這些產品獨占市場,甚至有的已獨占十年,仿制藥一直未能進入市場的原因就是原研藥專利的限制。
以下,具體來看這些藥品中,目前國內申報企業數量最多的 7 個:
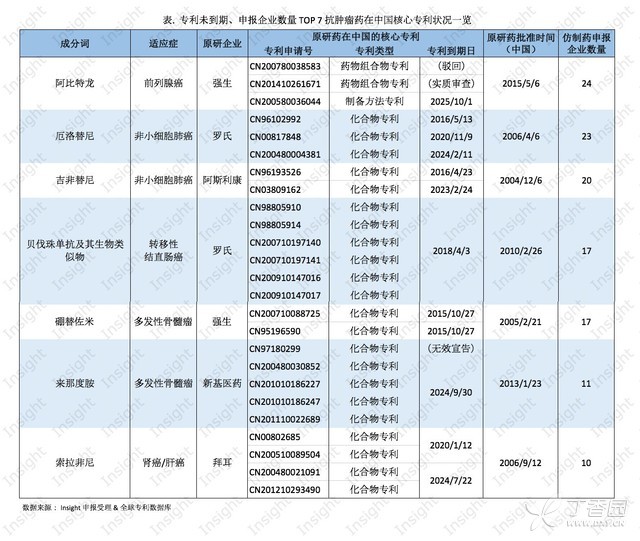
如上表,申請企業數量最多且大多被退審的阿比特龍,原研企業強生制藥在中國是沒有化合物專利的,其制備方法專利于 2025 年到期。對仿制藥企業來說,制備方法專利比較容易繞開。
雖然阿比特龍的競爭暫時小了,但強生今年要面臨硼替佐米的專利到期,該藥已獨占中國市場 10 年,即將因化合物專利到期而遭遇 16 家企業的市場爭奪。
羅氏的厄洛替尼、阿斯利康的吉非替尼進入中國市場也有十年之久,雖然它們的核心化合物專利將于 2016 年過期,但這兩個化合物的不同晶型專利離到期還有 5 年以上。目前已分別有 20 多家仿制藥企業對這兩個產品虎視眈眈。
同樣以多晶型化合物來保護專利的還有來那度胺,距離其晶型專利屆滿還有 9 年,目前申報企業數量為 11 家。
羅氏的貝伐珠單抗于 5 年前在中國上市,目前已有 17 家企業申報其類似物,距離其化合物專利屆滿還剩 3 年時間。
在印度被強制許可的索拉非尼(Nexavar),其中國化合物專利還有 5 年到期,而包含前藥、代謝物和藥物組合物的化合物專利則還有 9 年。
倘若按照「癌癥防治計劃」,未來三年內,不僅索拉非尼,包括貝伐珠單抗、來那度胺在內的抗腫瘤藥都將成為可能被強制許可的對象,成為印度下一個 Nexavar。
談論強制許可時,我們還要談論什么?
表面上看,一個國家是否應該實施藥品專利強制許可,是一個涉及公共健康和藥品價格的可及性的問題,而事實上,這還是一個專利鏈接和首仿藥保護制度缺失的問題。
我們來看看美國是怎么做的。美國 Hatch-Waxman 法案中規定了專利鏈接制度,包括專利聲明、橘皮書、仿制藥簡化申請、數據獨占等,尤其是在此基礎上的首仿藥數據保護制度,允許仿制藥企業通過第四段專利聲明來挑戰原研藥市場獨占,首仿藥上市后還有 180 天市場保護期。
專利鏈接和首仿藥保護制度很好地平衡了原研藥與仿制藥企業之間的利益,既保護了原研藥的專利權,也鼓勵仿制藥企業挑戰原研藥,形成良性競爭,從而加快仿制藥上市速度,降低價格,保障藥品可及性。
再回顧印度,印度現行的《藥品和化妝品法》中專利鏈接制度是缺失的,卻一味地以「滿足公眾藥品可及性」為由來實施專利強制許可加快仿制藥上市速度,未免有種「頭疼醫腳」的嫌疑。
同樣的,中國《藥品注冊管理辦法》中雖然規定了專利狀況聲明、仿制藥申請限制、數據獨占、監測期保護等條款,但是相比美國的專利鏈接和首仿藥制度仍不夠成熟,就連「首仿藥」的定義在中國法規中都是找不見蹤影的。
在尚沒有從制度上平衡好專利藥與仿制藥利益的環境下,在中國從仿制藥大國向創新藥國家轉型之時,如果開始實施藥品專利強制許可制度,是否有失偏頗?
印度頒布首個強制許可后,印度藥品生產商組織曾這樣表示:
強制許可只能適用于特殊情況,如國民健康危機時期。如果濫用強制許可,將破壞藥品行業的創新能力,從長遠看,將危害到患者。
所以,不提供仿制藥健康競爭環境的專利強制許可,一定程度上就是「耍流氓」,明明是一項保障公共健康的國際制度,卻淪為了被利用的工具。
不過,國家衛計委的計劃中似乎也給出了另一個提高抗腫瘤藥物可獲得性的方案,即「通過建立談判機制,降低采購價格」。
這句話可理解為「為了降低原研藥采購價格的談判」,也可解讀為「為了實施強制許可并降低原研藥采購價格的談判」。
如果是前者,那么專利實施強制許可僅是一只紙老虎,是政府用之與原研企業談判從而降低藥品價格的「籌碼」。
那么所幸,中國不會成為下一個印度。
累計代理量
城市布局
團隊實力
服務用戶數